قبل سنوات قليلة، اطّلعتُ على مفهوم العلاج المناعي والطريقة التي بدّل فيها الحرب على السرطان. ووفق تقرير أصدرته الشركة الصيدلانية العملاقة "فرما" PhRMA، وصل عدد العلاجات المناعيّة التي يشتغل عليها العلماء في 2017 إلى قرابة 250 علاجاً. وفي تشرين أول (اكتوبر) 2018، ذهبت جائزة نوبل في الطب مناصفة إلى الباحثين جايمس آليسون وتاسوكو هونجو تكريماً لأعمالها البحثية الرياديّة التي أسهمت في إطلاق ثورة العلاج المناعي للسرطان.
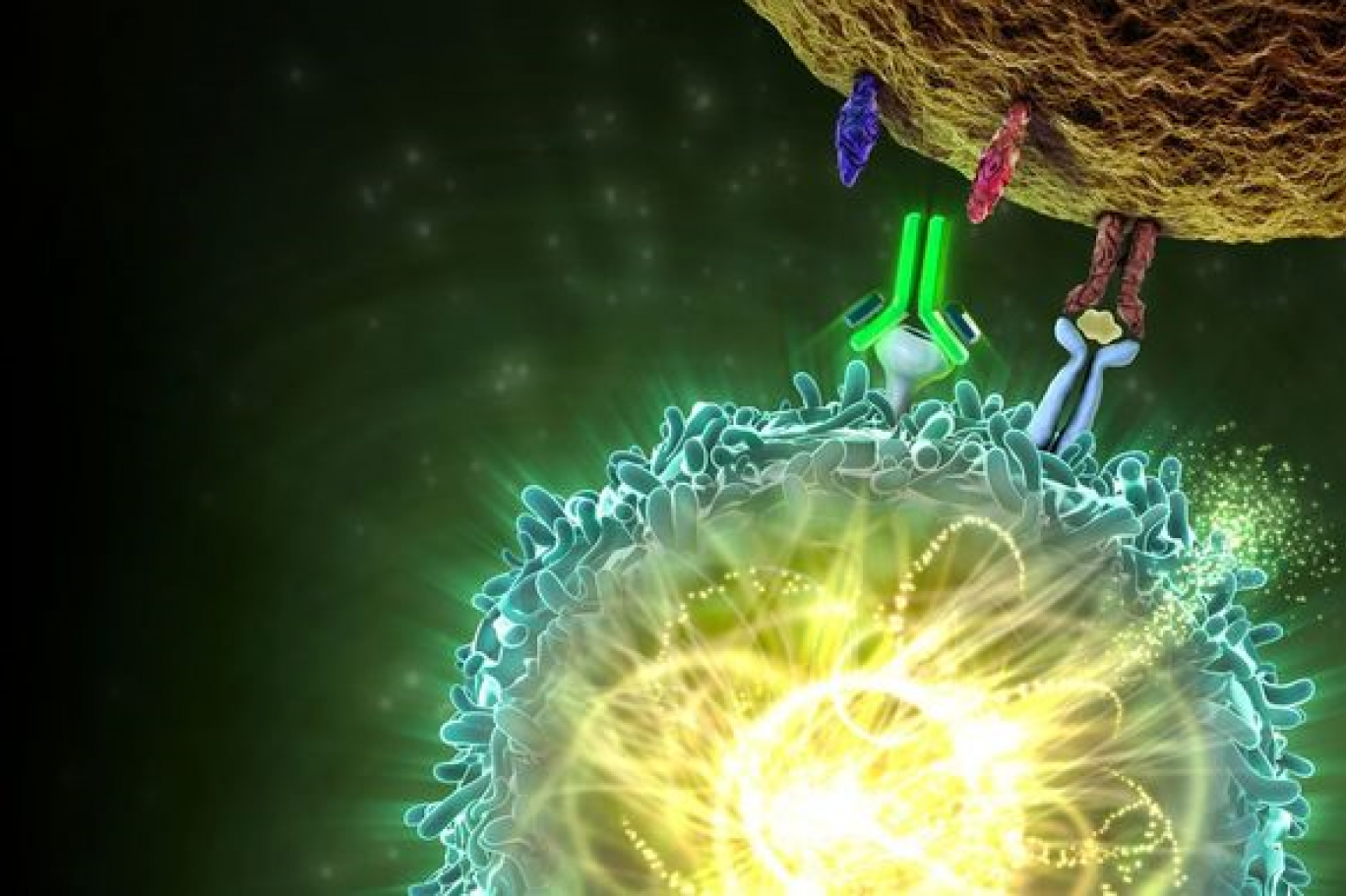
إذ اكتشف آليسون، أستاذ أكاديمي في "مركز أم دي آندرسون للسرطان" في هيوستون، التابع إلى "جامعة تكساس"، أنّ مكوّناً بيولوجيّاً في جهاز المناعة يسمّى "سي تي آل إيه- 4" CTLA-4 يعمل بطريقة تشبه عمل "الفرامل"، بمعنى أنه يكبح نشاط عناصر مناعيّة تتمثّل مهمتها الأساسيّة في مكافحة الأورام السرطانية. وتذكيراً، عندما يظهر تركيب سرطاني في الجسم، يتصدّى جهاز المناعة ويحاول ضربه والتخلص منه. وعندما لا تُنْجَزْ تلك المهمة الحميدة، تنفلت الخلايا الخبيثة وتتكوّن الأورام الخبيثة المختلفة. بكلمات أكثر علميّة، يعمل المكوّن "سي تي آل إيه- 4" على "فرملة" خلايا مناعيّة تقاوم الخلايا الخبيثة وتلتهمها التهاماً. ووفق ما اكتشفه آليسون، تؤدي إزالة تلك "الفرملة" إلى انطلاقة قويّة للخلايا المناعيّة التي تقاوم السرطان، ما يسهم في الشفاء منه. واستدراكاً، ينطبق ذلك الوصف على مجموعة من الأورام الخبيثة، وليس بالضرورة عليها كلها. وصرف آليسون 17 سنة كي يقنع آخرين بجدوى تلك المقاربة، ما أدّى في 2011 إلى الموافقة على دواء مناعي اسمه "يرفوي" Yervoy (اسمه العلمي "إيبيليموماب" Ipilimumab) استطاع أن يحقق ما يشبه المعجزة في علاج سرطانات جلدية لدى مجموعة من المرضى.
في المقابل، درس هونجو، أستاذ في "جامعة كيوتو" اليابانية، نوعاً آخر من المُكوّنات التي تعمل كأنها "فرامل" جهاز المناعة، تحمل اسم "بي دي- 1" PD-1 (طريف معرفة أن الاسم يختصر عبارة علمية مفادها "الموت المُبَرمَج للخلايا- 1"). وأعطى نجاح آليسون في استخدام "سي تي آل إيه- 4" ضد السرطان، دفعاً لعمل هونجو، وصار مقتنعاً بإمكانية النجاح في استعمال "بي دي- 1" ضد الأورام الخبيثة على غرار ما حصل مع "سي تي آل إيه- 4". أبعد من ذلك، تبدّى لهونجو أن المُكوّن الذي يشتغل عليه أشد فعالية وأكثر أماناً من المُكوّن الذي عمل آليسون عليه. كذلك تبيّن لهونجو إمكانية تسخير المُكوّن "بي دي- 1" في علاج مروحة واسعة من الأورام الخبيثة، تشمل سرطانات في الرئة تفتك بما يزيد على 150 ألف أميركي سنويّاً. وظهرت أدوية تجمع المكوّنين السابقين سويّة، ما يعني أنها تزيل زوجاً من "الفرامل" التي تكبح نشاط جهاز المناعة ضد السرطانات، وتعطي دفعاً قويّاً لعمل ذلك الجهاز في مقاومة مجموعات من السرطانات والتخلص منها.
وعلى مدار عقود، عكف العلماء على دراسة طُرُق للاستفادة من جهاز المناعة في جسم المُصاب بالسرطان كي يعمل بنفسه ضد الورم الخبيث ويتخلص منه. ولتحقيق تلك الغاية، جرّب العلماء الاستفادة من اللقاحات ووسائل اخرى، بهدف تعزيز نشاط جهاز المناعة ضد الأورام الخبيثة. في 2016، ألقى هونجو خطاباً عن تقبّله جائزة علمية مرموقة من "جامعة كيوتو"، قارن فيه بين الطريقة التي يُنظّم فيها الجسم عمل جهاز المناعة وبين التحكّم في نظام الإقلاع والسرعة في السيارة. وأشار إلى إن انطلاق عمل جهاز المناعة ضد السرطان يتطلّب تحرير "فرامل" التوقف في المرآب التي يمثّلها المُكوّن "سي تي آل إيه- 4"، ما يتيح الضغط على دوّاسة البنزين لزيادة السرعة تدريجياً بهدف الخروج من المرآب. ويمثّل "بي دي-1" نوعاً آخر من "الفرامل"، لأنه يشبه المكابح التي تستعمل أثناء السير على الطريق، وتبطئ سرعة عمل النظام ككل، ويترجم ذلك، في حالة السرطان، بمنع جهاز المناعة من التصدي للغزو الذي تمثّله الخلايا السرطانية الخبيثة. واستطراداً، يعمل المُكوّنان "سي تي آل إيه- 4" و"بي دي- 1" كأنهما "نقطة تحكّم مروري" بالنسبة لسير نشاطات جهاز المناعة ضد السرطانات، خصوصاً قدرة ذلك الجهاز على إفراز أجسام مضادة تعمل على ضرب الورم الخبيث والتخلص منه. وأحياناً، يسمّى العلاج الذي يستهدف التخلص من التوقّف الذي يسببه المُكوّنان المذكوران، "التخلّص من التوقّف في نقاط التحكّم" التي تعيق عمل الأجسام المناعيّة المضادة. وكذلك ظهرت أنواع اخرى من العلاجات المناعيّة ضد السرطان، استلهمت بطريقة أو اخرى أعمال آليسون لكنها طبّقت مفاهيمه على مناحٍ اخرى في الأورام الخبيثة.
وحاضراً، يقود العلاج المناعي الجهود العلمية المبذولة في مجال الأدوية المشخصنة Personalized Medicines التي تُعرّف بأنها الأدوية التي تصنع بالاستناد إلى المعطيات الشخصية لكل مريض على حدة، فكأنها تُفَصّل على مقاس جسمه ومرضه وحالته. وفي العقدين الأخيرين، انتقل التركيز في علاج السرطان من استخدام الأدوية الكيمياوية والعلاج بالأشعة، إلى الأدوية المناعيّة المتخصصة بنوع معيّن من أجسام المناعة (تسمّى "الأجسام المناعيّة المُضادة ذات النمط الواحد") ثم وصل الأمر حاضراً إلى ظهور علاجات تنشّط جهاز المناعة عند المريض كي يعمل بنفسه على مقاومة السرطان.
وكذلك يجري التعامل حاضراً مع الورم السرطاني لدى المريض كأنه بصمة أصبع، بمعنى أنه يمتلك مواصفات خاصة بذلك المريض، تميّزه عن سواه. تقدّمت تلك المقاربة العلاجيّة بدفع جاء أساساً من التطوّر في وسائل التشخيص. وبدلاً من الاكتفاء بتحديد نوع النسيج السرطاني وموقع الورم الخبيث، يستخدم البحّاثة حاضراً أدوات تتعرّف على السمات الجينية في السرطان، وكذلك أنواع التراكيب الجينية التي تستعملها الأورام في "إبراز" نفسها وتشغيل آلياتها، إضافة إلى الطفرات الجينية التي ترافق الورم السرطاني ويسميها العلماء "نيوأنتيجينز" Neoantigens.
أدّى اكتشاف طرق جديدة في تشخيص السمات المميزة للسرطانات إلى تطوير مقاربات علاجيّة مختلفة، بمعنى أنها تستند إلى الملامح المميزة لكل ورم خبيث على حدة. في العام 2017، وافق "المكتب الأميركي للغذاء والدواء" على استعمال دواء سرطاني جديد اسمة "كيترودا" Keytruda (اسمه العلمي "بيبمبروليزوماب" Pembrolizumab)، في علاج أنواع معينة من الأورام الخبيثة. وتحديداً، يعمل "كيترودا" بكفاء ضد أنواع من السرطانات يتضمّن تركيبها الجيني تجمّعات بارزة من التسلسلات الوراثية المغلوطة. وتوضيحاً، يتكوّن الحمض الوراثي في الخلايا (الجينوم) من مجموعة كبيرة من التسلسلات الجينية. وأثناء حياة الخلايا وتكاثرها طبيعياً، تحدث بعض الأخطاء أثناء إعادة "طباعة" الحمض الوراثي في الخلايا الجديدة، تشبه حدوث أخطاء مطبعية في الكتب. وفي الحالة الطبيعية، هناك تشكيلات في الخلية تتولّى تصحيح تلك الأخطاء "الطباعيّة" أو بالأحرى تتخلص منها. في حالة السرطان، يسير تكاثر الخلايا السرطانية بسرعة كبيرة، ما يعني أيضاً وجود تراكمات من أخطاء "الطباعة" للجينوم فيها. وأحياناً، يحصل التكاثر السرطاني المنفلت في خلايا لا تحتوي على التشكيلات التي تتخلص من أخطاء "طباعة" الجينوم، ما يؤدي إلى تراكم تلك الأخطاء ثم تَجمّعها في أكوام تصبح كأنها "علامات مميزة" لذلك النوع من السرطانات. ويُشار إلى تلك الأنواع من السرطانات بمصطلح "إم إس آي- آتش"/"دي أم أم آر" MSI-H/dMMR. ويملك "كيترودا" كفاءة عالية في التعامل مع تلك الأنواع السرطانية. ويعتبر "كيترودا" أول دواء سرطاني حصل على موافقة لاستعماله بناءً على المؤشّرات البيولوجية الجينية، وليس مجرد نوع النسيج في العضو الذي ظهر فيه الورم الخبيث (= الرئة أو الثدي أو القولون...). وتحمل تلك الدقة في تعريف نوع السرطان، وعداً بأن تكون الملمح الأساسي الذي يقود جهود معالجة الأورام الخبيثة.
وبصورة تقريبية، يستجيب خُمْسُ المُصابين بالأورام السرطانية للعلاجات من نوع "التخلّص من التوقّف في نقاط التحكّم"، بمعنى أنها مستندة إلى اكتشافي آليسون وهونجو، مع ملاحظة مثيرة قوامها أن نصف من يستجيبون لتلك العلاجات تستمر أجسامهم في نشاطاتها المناعيّة المُضادة للسرطانات، لسنوات عدّة.
هناك خلايا معينة في جهاز المناعة تتميّز بقدرتها على التهام الخلايا الخبيثة، وكل التراكيب التي يرغب جهاز المناعة في التخلّص منها. ويُشار إلى تلك الخلايا بحرف "تي" T. وشهد العام 2017، تطوّرات مهمة في المقاربات العلاجية المستندة إلى صُنْع خلايا "تي" مُعدّلة وراثياً بطريقة تجعلها شديدة الفتك بأنواع معينة من السرطانات. ويشمل العلاج استخراج خلايا "تي" جسم المريض، ثم تعديلها وراثياً بما يجعلها تتعرف بسهولة على الخلايا الخبيثة التي يجب مهاجمتها. وفي التفاصيل أن تركيبة سطح خلايا "تي" التي أُخِذَتْ من المريض، تُعدّل كي تكون متطابقة مع مؤشرات جينية معينة تبرز على "سطح" الخلية السرطانية. وعندما يُعاد حقن تلك الخلايا إلى جسم المريض، فإنها تنطلق وتسير بسرعة صوب هدفها المتمثّل في الخلايا السرطانية التي تحتوي تلك المؤشّرات الجينية، كي تضربها وتدمرها وتلتهمها. وتسمّى تلك الخلايا العلاجية الملتهمة "كار- تي" CAR T. ووصل معدل نجاح العلاج بتلك الطريقة إلى قرابة 90% عند الأطفال والشباب المُصابين بسرطان الدم اللمفاوي من النوع "ب". في المقابل، أظهر هذا العلاج أعراضاً جانبية كثيرة وشديدة ويصعب التعامل معها.
وحاضراً، صار العلاج بخلايا "كار- تي" و"التخلّص من التوقّف في نقاط التحكّم" أمراً متحققاً، لكن ثمة ثغرات كثيرة في أدوات الطب المعاصر في ذلك الحقل. إذ لا تستجيب سوى شريحة صغيرة من مُصابي السرطان للعلاج بالأدوية المستندة إلى "سي تي آل إيه- 4" و"بي دي- 1"، مع عدم وجود تفسير علمي وافٍ عن تلك الظاهره. وثمة تحديدات كثيرة تقيّد استعمال العلاج بخلايا "كار- تي" من بينها أنها تعمل على أنواع معينة من المؤشّرات الجينية التي لا تكون بالضرورة موجودة في السرطانات كلها، والأنكى أن بعض الخلايا الطبيعيّة تمتلكها ما يجعلها عرضة لهجوم خلايا "كار-تي" الملتهمة!
وتتمثّل أحد التحديّات المحورية في التعمق بتطوير طرق أكثر دقّة في التمييز بين الخلايا الطبيعية والسرطانية. ويلوح في الأفق أنّ مجموعة من المقاربات العلاجيّة المناعيّة للسرطانات، قد تستطيع التعامل مع تلك المشاكل بطرق مبتكرة.